A suspensão do lote 22300/095 do Cateter Intravenoso com Dispositivo de Segurança Injex-Cath SAFETY trouxe atenção para os critérios de controle de qualidade aplicados a dispositivos médicos no Brasil, afetando diretamente serviços de saúde que utilizam esse material em rotinas de atendimento e reforçando a importância da segurança do paciente e da conformidade com normas técnicas.
O que motivou a suspensão do cateter intravenoso Injex-Cath SAFETY?
O cateter intravenoso Injex-Cath SAFETY foi analisado no âmbito do Programa Estadual de Monitoramento da Qualidade dos Medicamentos e Congêneres (PROGMEC). O ensaio, realizado pela Fundação Ezequiel Dias (FUNED), avaliou se o dispositivo atendia às normas técnicas brasileiras e aos requisitos de desempenho e segurança.
O laudo apontou irregularidades na superfície externa do tubo da agulha, com acabamento insatisfatório e não conformidade com a norma ABNT NBR ISO 9626:2020, que regula agulhas hipodérmicas metálicas. Essas falhas representam risco potencial durante o uso clínico, justificando medidas preventivas por parte da Anvisa.
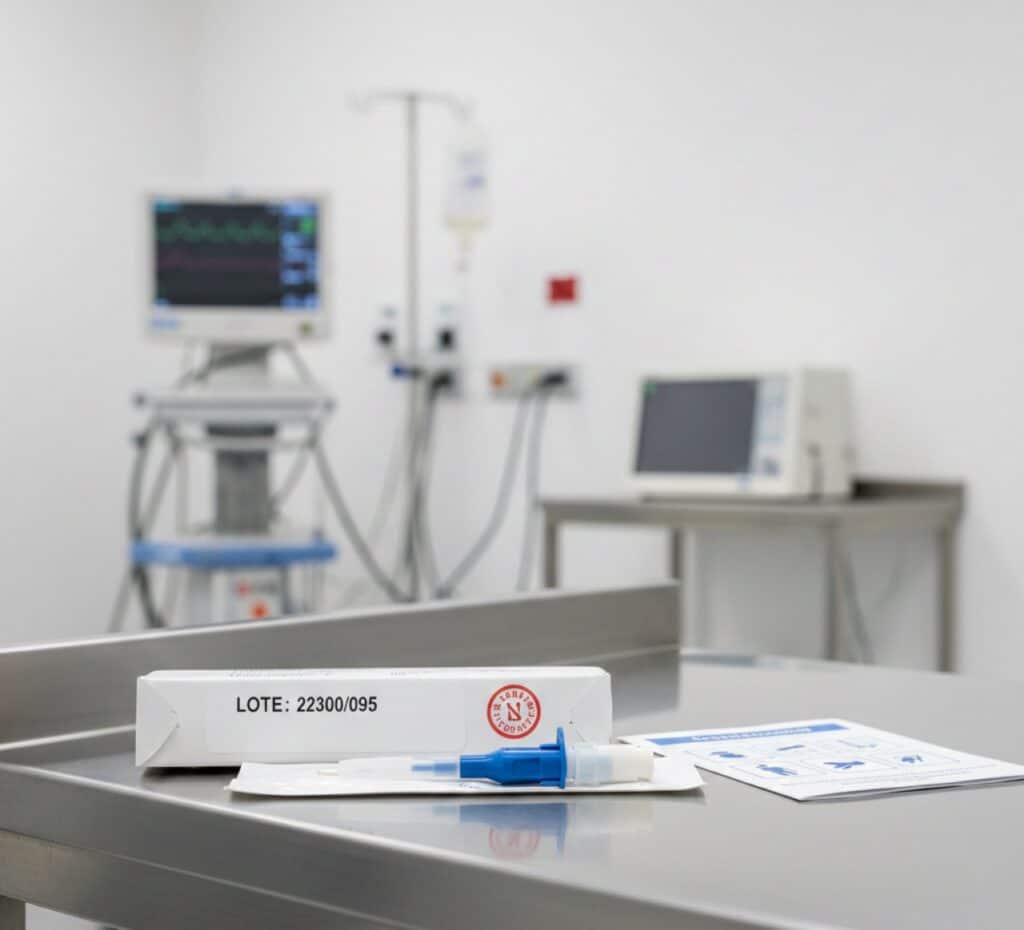
Quais medidas foram determinadas para o lote 22300/095 do Injex-Cath SAFETY?
A Resolução RE 5340/2025, publicada no Diário Oficial da União, definiu ações específicas para o lote 22300/095 do cateter intravenoso Injex-Cath SAFETY. A medida atinge toda a cadeia de fornecimento, do fabricante aos serviços de saúde públicos e privados, com foco em retirar o produto de circulação.
Para tornar mais claro o alcance da decisão regulatória, a resolução estabelece as seguintes determinações principais:
Determinações aplicadas ao lote 22300/095
ResoluçãoSuspensão da fabricação do lote específico identificado na análise.
Proibição de comercialização para distribuidores, hospitais, clínicas e demais compradores.
Proibição de distribuição gratuita, amostras ou qualquer forma de fornecimento.
Impeditivo à realização de propaganda e divulgação comercial do lote.
Obrigatoriedade de recolhimento de todas as unidades remanescentes do lote 22300/095.
Como a legislação embasa a ação da Anvisa nesse caso?
A intervenção relativa ao cateter intravenoso Injex-Cath SAFETY está amparada por normas sanitárias federais que tratam de dispositivos médicos. Essas regras permitem ações imediatas sempre que um produto apresentar risco potencial à saúde, mesmo na ausência de grande número de eventos adversos notificados.
Entre as principais bases legais estão a Lei 6.360/1976, que regula a vigilância sanitária de medicamentos e correlatos, a Lei 6.437/1977, que trata das infrações e sanções sanitárias, e a RDC 390/2020, que disciplina recolhimentos e ações de campo aplicáveis a produtos para saúde.
Quais orientações os serviços de saúde devem seguir diante da suspensão?
Diante da suspensão do lote do cateter intravenoso Injex-Cath SAFETY, as unidades de saúde devem revisar estoques e registros de compras para localizar o lote 22300/095. A rastreabilidade interna é essencial para evitar o uso acidental do material e organizar o retorno ao fabricante ou distribuidor.
Após a identificação, o material deve ser isolado fisicamente, rotulado como impróprio para uso e encaminhado para devolução, conforme orientação da empresa e da vigilância sanitária local. A substituição imediata por cateteres regularizados garante a continuidade da assistência sem prejuízo ao paciente.
Por que o controle de qualidade de cateteres intravenosos é tão relevante?
O cateter intravenoso com dispositivo de segurança é amplamente utilizado em pronto-atendimentos, enfermarias, UTIs e centros cirúrgicos. Qualquer defeito estrutural, como irregularidade na superfície da agulha, pode elevar o risco de falhas de punção, dor, sangramentos ou danos teciduais.
Normas como a ABNT NBR ISO 9626:2020 definem parâmetros mínimos de resistência, acabamento e integridade do tubo metálico. Quando um lote, como o Injex-Cath SAFETY 22300/095, não atende a esses critérios, a retirada de circulação torna-se medida de prevenção fundamental, reforçando a importância do monitoramento regulatório contínuo.


