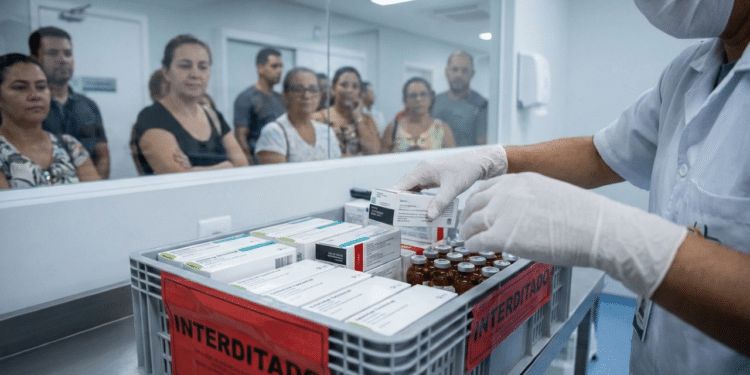
A suspensão temporária de dois medicamentos hospitalares pela Agência Nacional de Vigilância Sanitária (Anvisa) reacendeu o debate sobre segurança de fármacos no país. A medida, de caráter preventivo, foi adotada após relatos de alterações visuais em um antibiótico e suspeita de contaminação em um anestésico amplamente usados em ambiente hospitalar, afetando diretamente serviços de saúde públicos e privados.
O que significa a suspensão de medicamentos pela Anvisa?
Quando ocorre a suspensão de medicamentos pela Anvisa, a Agência determina que determinados lotes deixem de ser utilizados, comercializados ou distribuídos em todo o território nacional. A medida é cautelar e se baseia em indícios consistentes de falhas, mesmo antes da conclusão das análises laboratoriais.
O impedimento envolve o antibiótico Vancotrat 500 mg, fabricado pela União Química, e o anestésico Cloridrato de Lidocaína 20 mg/ml, da empresa Hypofarma. No caso do antibiótico, o alerta foi gerado porque, após a diluição, a solução apresentou um tom alaranjado incomum, divergente do aspecto transparente normalmente esperado.

Como funciona a medida cautelar adotada pela Anvisa?
No contexto da Anvisa, uma medida cautelar é uma decisão administrativa emergencial e provisória para prevenir possíveis danos à saúde pública. Ela se ancora no princípio da precaução, permitindo suspender fabricação, distribuição, comercialização ou uso mesmo antes da comprovação definitiva do risco sanitário.
Enquanto os lotes interditados ficam isolados, laboratórios oficiais e independentes realizam testes físico-químicos e microbiológicos. Após a conclusão, a medida pode ser revogada ou convertida em ações definitivas, como recolhimento nacional, cancelamento de registro e sanções ao fabricante.
Quais riscos são avaliados na suspensão de medicamentos pela Anvisa?
Na suspensão de medicamentos, os técnicos analisam diferentes tipos de risco para evitar eventos adversos como reações inesperadas, infecções e perda de eficácia terapêutica. No episódio recente, a coloração alterada do antibiótico e o corpo estranho no anestésico indicaram possíveis falhas de qualidade.
Esses riscos são avaliados considerando o impacto em pacientes internados, especialmente em terapia intensiva e centros cirúrgicos, e costumam ser classificados em categorias específicas:
- Risco toxicológico: presença de substâncias não previstas na fórmula ou degradação do princípio ativo.
- Risco microbiológico: contaminação por bactérias, fungos ou outros microrganismos nocivos.
- Risco físico: partículas sólidas, corpos estranhos ou turvação da solução injetável.
- Risco terapêutico: perda da concentração adequada do fármaco, com falha potencial no tratamento.

Como profissionais de saúde devem agir diante da suspensão?
Em situações de suspensão de medicamentos pela Anvisa, hospitais, clínicas e farmácias devem adotar protocolos para impedir que os produtos cheguem aos pacientes. As instituições costumam ativar rotinas internas logo após a publicação de notas técnicas ou resoluções da agência reguladora:
- Identificação dos lotes: localizar rapidamente todas as unidades citadas no comunicado oficial.
- Segregação física: retirar os produtos dos setores assistenciais e armazená-los em área identificada como “interditado”.
- Registro em sistema: atualizar o estoque eletrônico, evitando liberações automáticas.
- Comunicação interna: informar equipes médicas, de enfermagem e farmácia clínica sobre a proibição temporária.
- Busca de alternativas: definir substitutos terapêuticos disponíveis, respeitando protocolos e diretrizes clínicas.
Por que a suspensão de medicamentos pela Anvisa fortalece a segurança?
A repetição de suspensões de medicamentos pela Anvisa está ligada ao funcionamento da farmacovigilância brasileira, que depende de notificações de profissionais, pacientes e empresas. Esse fluxo de dados torna o controle mais dinâmico e reduz a chance de eventos graves em larga escala.
As interdições preventivas também estimulam melhorias industriais, com revisão de processos, manutenção de equipamentos e aprimoramento de sistemas de qualidade. Para pacientes e serviços de saúde, é essencial acompanhar comunicados oficiais, conferir rótulos e lotes e relatar prontamente qualquer suspeita de anormalidade.